Osebne zbirke


Razumevanje osnovnih gradnikov snovi in njihove medsebojne povezanosti nam omogoča globlje razumevanje nekaterih fizikalnih lastnosti snovi.
Pojem osnovni gradniki pomeni tiste najmanjše delce, na katere lahko fizično "razstavimo" neko snov. Pri tem snov ostaja enaka, dokler ostajajo enaki osnovni gradniki (npr. snov ostaja enaka četudi spremeni agregatno stanje). Osnovni gradniki se lahko spremenijo samo s kemijsko reakcijo. A s kemijsko reakcijo se spreminja tudi sama snov.
Osnovni gradniki snovi so:
ioni.
V tem gradivu bomo obravnavali lastnosti različnih snovi. Obravnavali bomo:
tališče,
mehanske lastnosti,
električno prevodnost,
topnost.
Te lastnosti so neposredno odvisne od zgradbe snovi - ali drugače rečeno: od gradnikov in vezi med njimi.
Trdne snovi, pri obravnavi njihovih lastnosti, ločimo na:
amorfne snovi;
kristalne snovi.
Poglejmo si obe skupini pobližje.
Amorfne snovi so snovi, ki imajo neurejeno razporeditev gradnikov.
Posebnih lastnosti amorfnih snovi na srednješolski ravni ne obravnavamo, zato se jim bomo ognili tudi v tem gradivu.
Kristali ali kristalne snovi imajo geometrijsko pravilno razporeditev gradnikov.
Večina čistih snovi tvori kristale, zato bomo v nadaljevanju govorili kar o zgradbi kristalov. To gradivo obravnava gradnike, vezi in lastnosti kristalov. Geometrijsko urejenost gradnikov obravnava naslednje gradivo.
Glede na gradnike in vezi razlikujemo štiri vrste snovi ali kristalov:
ionske,
kovalentne,
molekularne in
kovinske kristale.
Poglejmo si jih.
Glavna značilnost ionskih kristalov je, da:
so osnovni gradniki kationi in anioni,
ki so med seboj povezani z ionskimi vezmi.
Praviloma so ionske spojine sestavljene iz kovine in nekovine (nekovin).
Obstajajo pa tudi izjeme, ki niso iz kovine in nekovine.
Za ionske kristale so značilne takšne fizikalne lastnosti:
Tališča ionskih kristalov so visoka
Ker so ionske vezi močne, je potrebna sorazmerno visoka temperatura, da se razcepijo - to pomeni od nekaj sto stopinj celzija navzgor. Zaradi visokih tališč so vse ionske snovi pri sobni temperaturi v trdnem agregatnem stanju.
Ionski kristali so krhki in drobljivi, njihova trdota pa je različna.
Drobljivost je posledica dejstva, da ob majhnih premikih plasti v ionskem kristalu pride do odboja med istovrstnimi ioni.
Ionski kristali v trdnem stanuju ne prevajajo električnega toka; raztopine in taline ionskih snovi pa ga.
Da bi snov lahko prevajala električni tok, mora vsebovati gibljive delce z električnim nabojem. V trdnem kristalu so ioni togo vezani, zato se ne morejo gibati. V talinah in raztopinah ionskih snovi pa se ioni lahko gibljejo. Pod vplivom zunanje napetosti se bodo gibali v določeni smeri, kar lahko zaznamo kot električni tok.
Nekateri ionski kristali so topni v vodi, nekateri pa ne.
Topnost snovi je kompleksen pojav, na katerega vpliva več dejavnikov. Zato ni mogoče enostavno predvideti, katera snov se lahko raztaplja v določenem topilu. Pri ionskih snoveh si pomagamo z izkustvenimi spoznanji v obliki pravil, iz katerih sklepamo na topnost določene snovi.
Za druga topila pa velja, da so ionske snovi večinoma netopne.
Glavne značilnosti molekulskih kristalov so:
osnovni gradniki so molekule,
ki jih povezujejo medmolekulske sile.
Večina znanih snovi (vendar ne vse!) je zgrajena iz molekul. Ko govorimo o njihovih fizikalnih lastnostih, jih lahko obravnavamo kot molekulske kristale. Pri tem nekatere od teh snovi niso v trdnem agregatnem stanju pri sobni temperaturi, temveč kristalizirajo šele pri nižjih temperaturah.
Atomi nekovin in atomi polkovin in nekovin se v molekule povežejo s kovalentimi vezmi. Zato so molekule, ki sestavljajo molekulske kristale, navadno sestavljen iz nekovin ali polkovin in nekovin. Obstajajo tudi izjeme, kjer se nekateri atomi kovin z nekovinami povežejo s kovalentno vezjo.
Značilne fizikalne lastnosti molekulskih kristalov so:
Tališča so nizka.
Sile med molekulami so mnogo šibkejše od kemijskih vezi, zato se pretrgajo že pri nizkih temperaturah, mnogokrat pri nižjih od sobne temperature.
Molekularno zgrajene snovi so zato pri sobni temperaturi lahko v trdnem, tekočem ali plinastem agregatnem stanju. Nekatere so v obliki kristala le pri znižanih temperaturah, na primer:
voda 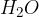 : voda zaledeni pri temperaturi 273,15 Kelvina;
: voda zaledeni pri temperaturi 273,15 Kelvina;
ogljikov dioksid 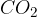 : ogljikov dioksid se spremeni v trden, suhi led pri temperaturi 216,6 Kelvina;
: ogljikov dioksid se spremeni v trden, suhi led pri temperaturi 216,6 Kelvina;
trden dušik 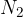 : dušik se spremni v trdno agregatno stanje pri 63.15 Kelvina, najdemo ga pa na površini oddaljenega pritlikavega planeta Pluton.
: dušik se spremni v trdno agregatno stanje pri 63.15 Kelvina, najdemo ga pa na površini oddaljenega pritlikavega planeta Pluton.
Molekulski kristali so krhki in drobljivi, večinoma so tudi mehki.
Vzrok so šibke sile med gradniki.
Topnost molekularnih snovi je različna.
Topnost molekulskih kristalov je odvisna od topila:
Topnost v vodi
V vodi so topne snovi, ki tvorijo vodikove vezi z molekulami vode.
Topnost v nepolarnih in šibko polarnih topilih
V nepolarnih in šibko polarnih topilih so topne snovi, katere molekule se povezujejo z Van der Waalsovimi vezmi.
Molekulski kristali ne prevajajo električnega toka v nobeni obliki.
Molekule so električno nevtralni delci, kar pomeni, da ne morejo biti nosilci električnega naboja. Izjema so le vodne raztopine kislin in baz, saj te snovi v vodni raztopini disociirajo (razpadejo) na ione.
Glavne značilnosti kovalentnih kristalov so:
osnovni gradniki so atomi nekovin,
povezani so s kovalentnimi vezmi.
Kovalentnih kristalov je malo: poleg štirih naštetih v gornjem primeru, je le še nekaj snovi, ki jih pa v srednješolskih programih praviloma niti ne omenjamo.
Fizikalne značilnosti kovalentnih kristalov so:
Tališča so zelo visoka.
Pri taljenju kovalentnega kristala se morajo razcepiti močne kovalentne vezi, kar je možno šele pri visoki temperaturi - nad 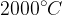 . Vse kovalentno zgrajene snovi so zato pri sobni temperaturi v trdnem agregatnem stanju.
. Vse kovalentno zgrajene snovi so zato pri sobni temperaturi v trdnem agregatnem stanju.
So zelo trdi.
Vzrok so močne in toge, usmerjene kovalentne vezi. Diamant ima najvišjo trdoto: 10 po Mohsovi primerjalni lestvici. Edina izjema je grafit, saj je mehak in celo "mazav" in se zato uporablja npr. za svinčnike, saj na beli podlagi pušča sivo sled.
Netopni so v vseh topilih.
Trdni kovalentni kristali ne prevajajo električnega toka, prav tako ne prevajajo taline.
Elektroni so lokalizirani - vezani - v kovalentnih vezeh med atomi, zato niso gibljivi.
Spet je izjema grafit - saj dobro prevaja elektriko. V grafitu je vsak atom ogljika povezan le s tremi sosednjimi ogljiki. Četrti elektroni vseh atomov tvorijo delokaliziran elektronski oblak, v katerem se elektroni lahko gibljejo.
Tako v molekulskih kot kovaletnih kristalih so prisotni atomi nekovin - a se med seboj v zgradbi (in s tem v fizikalnih lastnostih) bistveno razlikujejo:
v molekulskih kristalih so atomi povezani v molekule, te pa med seboj v kristal s šibkimi medmolekulskimi silami (glej sliko 1);
v kovalentnem kristalu pa so vsi atomi povezanimi v kristal z močnimi kovalentnimi vezmi (glej sliko 2).
Iz zapisane formule snovi, ki vsebuje atome nekovin, ne moremo ugotoviti, ali gre za kovalentni kristal ali za molekularno zgrajeno snov. To lahko ugotovimo iz:
modela ali
na osnovi poznavanja fizikalnih lastnosti konkretne snovi.
Kot je omenjeno v začetku podpoglavja, so kovalentni kristali zelo maloštevilni, zato si osnovne primere brez težav "na pamet" zapomnimo.
Glavne značilnosti kovinskih kristalov so:
osnovni gradniki so atomi kovin,
povezani pa so s kovinsko vezjo.
Med kovinske kristale spadajo vse kovine po periodnem sistemu (od litija do urana) in njihove zlitine.
Zanje so značilne fizikalne lastnosti:
Tipično visoka tališča
Tališča večine kovin so visoka, vendar obstajajo izjeme:
živo srebro, ki je pri sobni temperaturi edina tekoča kovina;
galij, ki ima tališče nižje od telesne temperature, približno 303 Kelvine.
alkalijske kovine, ki imajo tališča do največ 453 Kelvine (litij), kar je manj kot 200 stopinj celzija.
Preostale kovine imajo višja tališča, od nekaj sto stopinj celzija navzgor.
Kovine so trdne
Kovine niso krhke ali drobljive. So trdne in kovne - lahko jih mehansko oblikujemo s kovanjem, valjanjem, vlečenjem, itd. Razog za te lastnosti je v tem, da pri premikih aomov kovin ne pride do odbojev (kot npr. pri ionskih kristalih). Plasti atomov lahko drsijo druga ob drugi, kar omogoča mehansko oblikovanje brez drobljivosti.
Netopne so v vseh topilih.
Včasih rečemo, da se kovine raztapljajo v kislinah, vendar gre v tem primeru za kemijske reakcije, v katerih nastanejo soli (ionske spojine kovin), ne pa za porazdeljevanje atomov kovine med molekule topila.
Kovine so prevodne.
Kovine prevajajo električni tok kot trdnina ali talina. Razlog za to je v kovinski vezi, ki je elektronski oblak. Pod vplivom zunanje električne napetosti (v električnem polju) se elektroni v kovini začno urejeno gibati, kar zaznamo kot električni tok.